Korrosionsvorgang
Als Korrosionsvorgang bezeichnet man jene Reaktion, die die Korrosion eines metallischen Werkstoffes mit seiner Umgebung verursacht. Bei dem Korrosionsvorgang, der auch als Korrosionsreaktion bezeichnet wird, handelt es sich um eine Phasengrenzreaktion, da diese meist von der Oberfläche eines Werkstoffes ausgeht.
Ursache für eine Korrosionsreaktion ist die thermodynamische Instabilität von Metallen gegenüber Oxidationsmitteln wie z. B. Luft oder wässrige Medien. Das bedeutet, Metalle können unter Elektronenabgabe mit Sauerstoff reagieren. Metalle, wie z. B. Stahl, haben somit das Bestreben, die bei der Stahlherstellung eingebrachte Energie wieder freizusetzen und in einen thermodynamisch stabileren, oxidischen Zustand überzugehen. Somit kann die Korrosion auch als eine Art Umkehr des Herstellungsprozesses betrachtet werden und die dabei entstehenden Korrosionsprodukte haben vielfach die gleiche Zusammensetzung wie die natürlich vorkommenden Erze.
Je nach Eigenschaften der Reaktionspartner, also des Korrosionssystems, kann es sich bei der Korrosionsreaktion um eine chemische oder elektrochemische Reaktion, sowie um einen metallphysikalischen Vorgang handeln. Chemische Korrosionsreaktionen sind z. B. Auflösungsvorgänge von Glas und Keramik in Alkalien, d. h. in basischen Lösungen mit hohem pH-Wert, oder die Auflösung von Kunststoffen in Lösungsmitteln. Ein metallphysikalischer Korrosionsvorgang ist z. B. die Versprödung metallischer Werkstoffe durch Wasserstoff, der durch Diffusion in das Metall eindringt.
Die in der Praxis überwiegend vorkommende Korrosionsreaktion ist die elektrochemische Reaktion. Diese findet in Anwesenheit eines ionenleitenden Mediums statt, indem elektrisch Ladungen durch geladene Atome oder Moleküle transportiert werden. Ein derartiges Medium wird als Elektrolyt bezeichnet, wobei es sich z. B. um Wasser mit darin gelösten Salzen handeln kann. Dieser Elektrolyt kann, sofern er in direktem Kontakt mit einem metallischen Werkstoff steht, an diesem Korrosion hervorrufen.
In der folgenden Abbildung ist der Korrosionsvorgang von Stahl in wässrigen Elektrolyten schematisch dargestellt. Jene Stelle an der die Eisenauflösung stattfindet, wird als Anode bezeichnet. An der Anode gehen die festen Eisenatome (Fe) des Stahls unter Abgabe von Elektronen (e-) in Lösung, wodurch Eisenionen (Fe++) entstehen. Die Elektronen wandern durch den Stahl in Richtung Kathode und werden dort durch eine Sauerstoffreduktion oder eine Wasserstoffentladung verbraucht. Welche der beiden Reaktionen stattfindet, hängt von der Art des Elektrolyten ab. In neutralen und alkalischen Medien findet die Sauerstoffreduktion statt, wobei Sauerstoff (O2), Wasser (H2O) und die an der Anode freigesetzten Elektronen zu Hydroxidionen (OH-) reagieren. In Säuren, d. h. Elektrolyten mit niedrigem pH-Wert, findet hingegen eine Wasserstoffentladung statt. Hierbei reagieren die H+-Ionen der Säure mit den Elektronen und es bildet sich atomarer Wasserstoff (H).
Die bei der Sauerstoffentladung entstehenden Hydroxidionen bewegen sich wiederum durch den Elektrolyten zur Anode und verbinden sich dort mit den in Lösung gegangenen Eisenionen (Fe++) zu Eisen(II)-Hydroxid (Fe(OH)2). Bei Sauerstoffzutritt reagiert das Eisen(II)-Hydroxid zu dem schwer löslichen Eisen(III)-Hydroxid (FeO(OH)), dem eigentlichen Rost am Stahl.
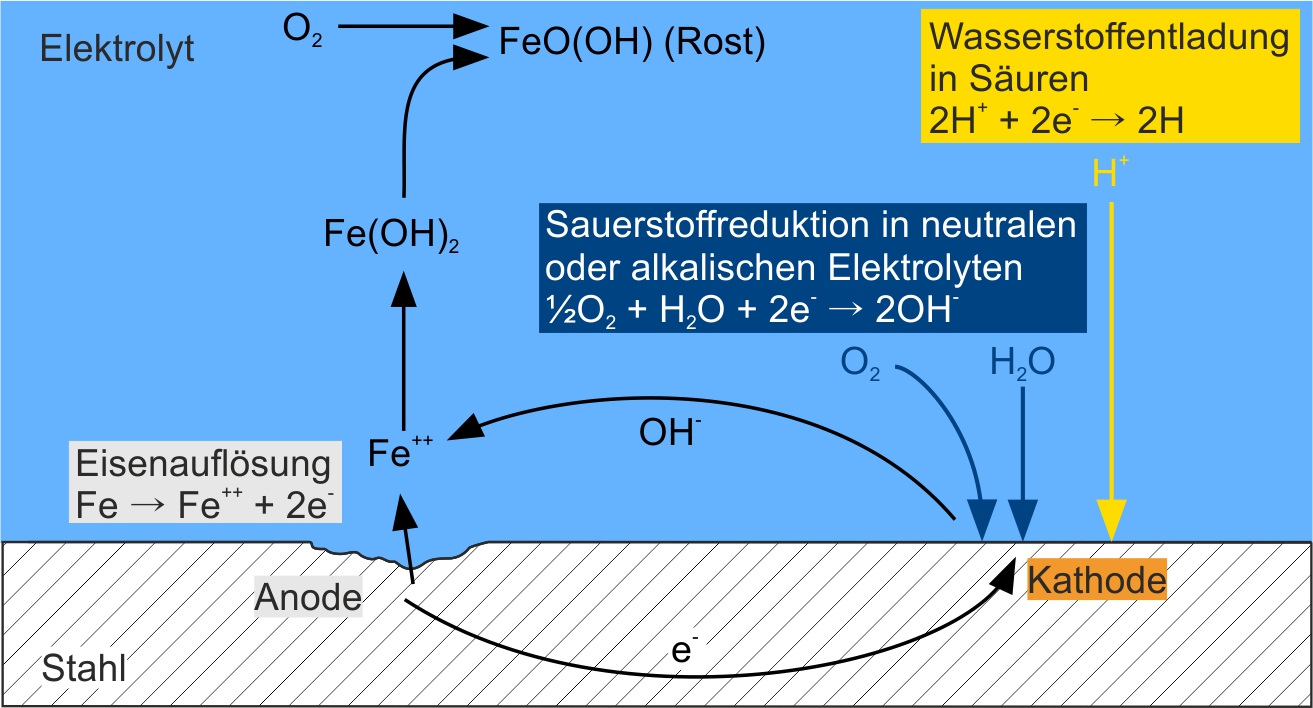
Korrosion kann nur dann stattfinden, wenn die Eisenauflösung an der Anode und der Verbrauch der Elektronen an der Kathode, d. h. durch eine Sauerstoffreduktion oder eine Wasserstoffentladung, gleichermaßen ablaufen können. Zusätzlich müssen sowohl die elektrische Leitfähigkeit des Metalls als auch die ionische Leitfähigkeit des Elektrolyten gegeben sein, damit ein Ladungsaustausch erfolgen kann. Es bildet sich somit in einem Korrosionselement ein geschlossener Stromkreis aus. Die bewusste Behinderung einer dieser Voraussetzungen hemmt die Korrosion und wird als aktiver Korrosionsschutz bezeichnet.
Synonym(e):
Korrosionsreaktion
Englische Übersetzung(en):
corrosion prozess, corrosion reaction
Creative Commons Namensnennung - Weitergabe unter gleichen Bedingungen 3.0 Deutschland (CC BY-SA 3.0 DE)
