Katalysator
Ein Katalysator bewirkt die Beschleunigung chemischer Reaktionen. Der Katalysator beeinflusst als Hilfsstoff den Reaktionsmechanismus, wird aber selbst in der Reaktion nicht verbraucht. Die Lage des thermodynamischen Gleichgewichts wird durch den Katalysator nicht verändert.
Prinzip
Der Katalysator bewirkt eine Veränderung des Reaktionsmechanismus der chemischen Reaktion. Die Aktivierungsenergie der katalysierten Reaktion ist verringert gegenüber der nichtkatalysierten Reaktion.
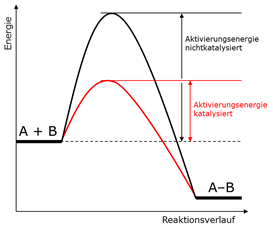
Die kleinere Aktivierungsenergie der katalysierten Reaktion bewirkt eine Erhöhung der Reaktionsgeschwindigkeit. Bei gleicher Konzentration und gleicher Temperatur ist die Reaktionsgeschwindigkeit ein Maß für die Katalysatoraktivität. Neben der Katalysatoraktivität ist die Katalysatorselektivität ist wichtiger Parameter, wenn bei einer Reaktion unterschiedliche Produkte entstehen. Ein selektiver Katalysator erhöht in diesem Fall nur die Reaktionsgeschwindigkeit zum gewünschten Produkt und unterdrückt dadurch die Bildung der anderen Produkte.
Unterscheidungen
Bei der homogenen Katalyse liegen die Reaktanden und der Katalysator in der gleichen Phase vor. Durch die gute Verteilung des Katalysators im Reaktionsmedium steht nahezu jedes einzelne Katalysatormolekül für die Reaktion zur Verfügung.
Bei der heterogenen Katalyse findet die Umsetzung von flüssigen oder gasförmigen Reaktanden an einem festen Katalysator statt. Die Oberflächenbeschaffenheit des festen Katalysators spielt dabei eine wesentliche Rolle.
Bei der Biokatalyse dienen Enzyme als Katalysatoren für die Beschleunigung chemischer und biochemischer Reaktionen.
Englische Übersetzung(en):
catalyst
Creative Commons Namensnennung - Weitergabe unter gleichen Bedingungen 3.0 Deutschland (CC BY-SA 3.0 DE)
